这是 达医晓护 的第 5760 篇文章
临床试验中,经常会听到“不良反应”、“不良事件”、“严重不良事件”等描述安全性的专业词汇,广大患者听闻后常会感到害怕,其中,“不良反应”与“不良事件”两个概念又非常容易混淆。 在此,我们可以把参加新药临床试验想象成一次探险的“航行”。研究医生好比是船员,试验用药则是船。而参加试验的患者是乘客,出门在外的首要任务就是要确保乘客的安全。而不良事件和不良反应等情况就如同航行中遇到的不同类型“风险”。 一、不良事件——航行中出现的任何不适 通俗理解 在“航行”中,参加试验的患者出现的任何不适。 定义 不良事件(Adverse Event, AE)指受试者接受试验用药品后出现的所有不良医学事件,可以表现为症状体征、疾病或者实验室检查异常,但不一定与试验用药品有因果关系。 解释 在参加试验期间,接受试验用药后,出现任何不好的医疗状况,或原有状况发生了变化,无论大小或严重程度,都被称为不良事件。但是产生的这些状况不一定和试验用药品相关,需要医生进行判断。 举例 在某治疗皮疹的药物试验中,受试者和家属因家庭琐事闹矛盾后发生肢体冲突,导致受试者摔倒后肘部骨折,由不良事件的定义可知,不良事件必须是医学事件,肢体冲突本身不是医学事件,但冲突导致的肘部骨折却是医学事件,因此,肘部骨折就属于不良事件。但是这个不良事件是因为摔倒导致的,与试验药物无关。 二、不良反应——怀疑或确认是“船”本身引起的不适 通俗理解 经过医生判断,怀疑或确定上述的不适就是 “船”(试验药物)引起的。 定义 不良反应(Adverse Drug Reaction, ADR),又称药物不良反应,指临床试验中发生的任何与试验用药品可能有关的对人体有害或者非期望的反应。试验用药品与不良事件之间的因果关系至少有一个合理的可能性,即不能排除相关性。 解释 不良反应是从不良事件里“挑选”出来的。当医生详细调查后,发现有合理的理由认为不适症状和试验药物之间存在因果关系时,这个不良事件就明确为不良反应了。 举例 在参加某种治疗细菌性肺炎的新药试验中,按疗程接受抗菌性试验药治疗后,肺炎症状消失,但出现腹泻的新症状,通过血液和粪便化验,医生判断腹泻是因长期服用试验药物而造成肠道菌群失调引起的,那么腹泻就是不良反应。 三、严重不良事件——需要立刻返航或求救的“大风浪” 通俗理解 需要马上或延长住院或可能会导致严重后果的大问题。 定义 严重不良事件(Serious Adverse Event, SAE)指受试者接受试验用药品后出现死亡、危及生命、永久或者严重的残疾或者功能丧失、需要住院治疗或者延长住院时间,以及先天性异常或者出生缺陷等不良医学事件。 鉴别关键点 严重不良事件强调的是不良事件的严重程度,而不是原因。它可能和试验药物有关,也可能只是试验参与者本身疾病的发展或突发了其他疾病。 举例 如果只是轻微头晕,那是不良事件。但如果头晕导致受试者摔倒,造成了严重脑出血需要立刻手术,这就是严重不良事件了。简单说:严重不良事件是拉响的“警报”,要求研究团队和监管部门高度重视,全力救治,并查明原因。 四、可疑且非预期严重不良反应——需要警惕的“突发危险风暴” 通俗理解 一个严重的、意想不到的、而且怀疑是药物引起的特大问题。 定义 可疑且非预期严重不良反应(Suspected Unexpected Serious Adverse Reaction, SUSAR)指临床表现的性质和严重程度超出了试验药物研究者手册、已上市药品的说明书或者产品特性摘要等已有资料信息的可疑并且非预期的严重不良反应。 解释 这是临床试验安全监测中最敏感、最需要警惕的信号。因为它既是严重的,又是意想不到的,而且很可能和试验药有关。 举例 研发一种治疗关节炎的新药,根据临床前研究,预估其可能会引起肠胃不适。但有受试者服药后,因出现了急性重症胰腺炎(非预期的),并且住院治疗(严重的),而医生判断这很可能与试验药有关(可疑的且属于不良反应)。那么,急性胰腺炎就是一个可疑且非预期严重不良反应,并应当按规定时间和要求向各级管理机构申报。 总结:一次安全的“航行”,离不开清晰的“风险识别” 通过上述“风险分类”,我们可以更清楚地了解 AE→ADR→SAE→SUSAR 的“风险信号灯”。在临床试验中,记录、分析和报告这些事件,不仅是科学研究的需要,更是对受试者安全和权益的保障。每一位受试者都是勇敢的“航海者”,而研究团队的责任,正是确保这次“航行”尽可能安全、透明、可控。把这张“航行风险图”收进口袋,您就能冷静看懂试验路上出现的每一阵风浪,既不盲目恐慌,也不掉以轻心。祝每位勇敢的“航海者”都能平安抵达新药的彼岸。 五、给“乘客”的自救手册——遇到风浪时应该怎么做? 立即“拉响警报” 不管不适多小,第一时间告诉研究医生(船员),切勿因“怕麻烦”而隐瞒。 记录“航海日志” 用纸质日记卡或手机备忘录,记下症状出现时间、持续时间、严重程度、是否服药、是否自行缓解。这些信息是医生判断因果关系的“GPS”。 保留“物证” 若出现皮疹、肿胀、血尿等,拍照或留样(如尿液、粪便),方便后续化验。 知晓“紧急频道” 每个试验都会给受试者留存一份事情同意书,上面印有 24小时热线、研究医院地址、联系人。出现胸闷、呼吸困难、意识模糊等“红色警报”时,直接拨打 120 并同步联系研究团队,比单线联系更省时。 拥有“下船权” 临床试验遵循“随时自愿退出”原则。如果您觉得风险大于获益,可随时“返航”,不会因退出而被剥夺常规医疗权益。 项目资助:国家新闻出版署医学期刊知识挖掘与服务重点实验室基金课题(2025YXQKSYS003-001)、上海市卫生健康系统党建研究会课题(wj2025074)、 上海市医院协会医院管理研究基金课题(X2025034) 作者:川北医学院附属医院 I期临床试验中心 徐庆宝 上海临床研究中心 临床研究部 杨葛亮 指导老师:海军军医大学第一附属医院 临床研究中心 张黎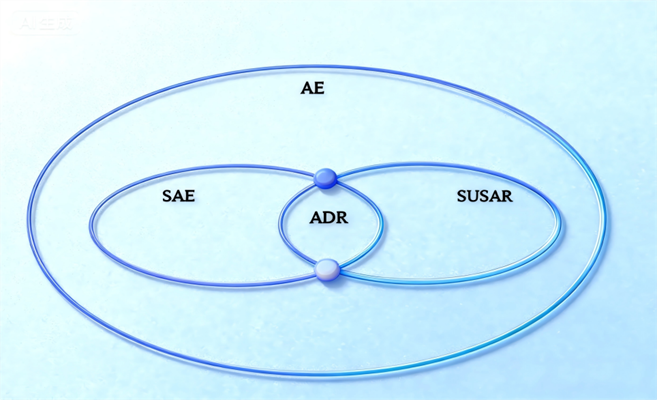






 收藏
收藏
 赞
赞