这是 达医晓护 的第 5609 篇文章
“医生,我的这个白色药瓶怎么只有一个标签啊?而且连个商标和批号都没有。”一位参加某临床试验的患者拿着药瓶正在询问其主治医生,其实,白瓶子里面装的就是临床试验用的药品。 一、什么是试验用药品? 试验用药品,指的是用于临床试验的试验药物和对照药品,试验药物就像正在参加入职培训待考核的“新员工”,尚处于“试用期”,还没有获得国家药监局正式颁发“工作证”,即未被批准上市。这些药物可能最终“转正”,成为上市药品;也可能因疗效或安全性问题而无法通过“试用期”。对照药品,指临床试验中用于与试验药物参比对照的其他研究药物、已上市药品或者安慰剂。 二、如何区分试验用药品和上市药品? 一般而言,从包装上,就可以比较容易地区分出试验用药品和常规药品。试验用药品的包装往往非常简洁,以白色或单色为主,避免使用炫丽鲜艳的图案或色彩,也没有商标和Logo。在一些临床试验中,为了区分不同的试验组别,可能会通过颜色代码或编号来标识不同剂量组,如红色标签代表高剂量,蓝色标签代表低剂量。此外,包装上还会印有“仅限临床试验用”、开展试验药厂的信息和方案名称等特殊标签。上市药品的包装相对精致,更加品牌化,常有企业标志、防伪标识和品牌专属配色。 三、试验用药品安全吗? 对试验用药品的安全性,好比处于入职培训阶段“新员工”的考核,“用人单位”只掌握初步的“背景信息”,这些数据主要来自动物实验和临床前研究。对于试验用药品的“能力特性”尚未完全摸清,可能存在潜在风险,如疗效欠佳或存在未知副作用,只有通过临床试验的验证,才算通过考核。而上市药品则经过了全面的“背景审查”,包括大量临床试验和实际临床应用数据。它们的“能力特性”已经被充分掌握,常见的不良反应都已记录在案,医生在使用时能够更有把握。 四、试验用药品谁可以用?怎么用? 前段时间,重庆某大医院“临床研究用药”外流市场事件曾引起社会广泛关注。客观来说,试验用药品的使用规则非常严格,想要参加试验的患者首先要进行知情同意,并签字确认,然后按照研究设计的入选标准和排除标准进行筛选,最终确定进入试验后,才会接受试验用药品的治疗,在此期间,药品管理由专门的机构和人员负责,研究医生和护士也会全程负责。因此,正常情况下,不会出现临床试验用药品外流市场的情况。 五、试验用药品怎么管理? 当前,能够开展药物临床试验的医院都已建立完善的试验用药品管理体系,主要包括了: (一)研究药物接收前准备 在试验获批伦理委员会审查同意后,一般由所发起试验的药厂提供试验用药品,经专门的临床协调人员办理相关手续来转运至医院的药品管理部门。 (二)研究药物的接收 这个阶段主要包括药品的转运、验收、清点,并签署相应的表单,主要由药品管理员负责。 (三)研究药物的保存 根据研究者手册、研究方案以及药品存储的客观要求,药物管理员负责保管试验药物,对药物贮存温湿度实行24小时监控报警管理,每日监测、记录温湿度。 (四)研究药物的发放 由研究护士凭研究医生开具的试验用药品处方,从专门的保存机构转运至病房或者门诊,对患者进行给药处理。 (五)研究药物及包装回收 依据研究方案要求,判定是否进行回收,如不回收将统一按照医院的规定进行处理。如需回收,由研究护士/临床研究协调人员回收至指定暂存机构,并清点好数量,做好记录。 (六)研究药物的退回和销毁 药品管理员、临床研究协调人员等定期清点待销毁试验用药品后,按照方案预定销毁流程退还药厂统一销毁。 六、试验用药品的监管力度如何? 临床试验用药品在研发过程中受到全程“重点关照”,从生产、包装、标签、运输、储存、发放、使用到回收、退回和销毁等各个环节,都有严格的规定和要求,还需要遵循《药物临床试验质量管理规范》等相关法律法规,验证试验用药品的安全性和有效性。同时,也需要国家药监局批准、医院伦理委员会批准、医院临床试验管理部门监管以及参与试验患者的知情同意,多重担保确保其规范、安全。 作者:上海市第九人民医院临床研究中心 沈慧青 上海临床研究中心临床研究部 杨葛亮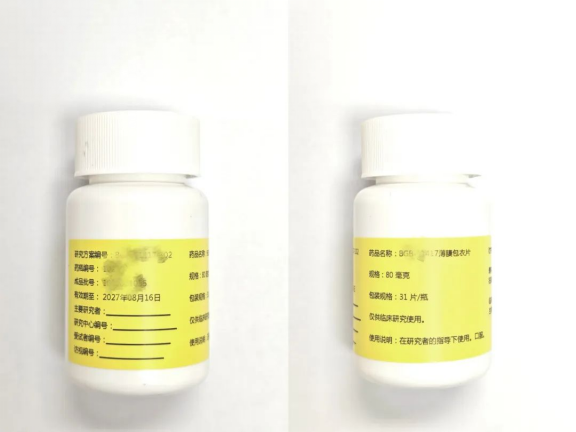
部分图片摘自网络,如有侵权请告知,予以删除。
所有人名和地名均为化名,如有雷同,纯属巧合。
临床研究杂志主编:杨葛亮






 收藏
收藏
 赞
赞